開発状況概要
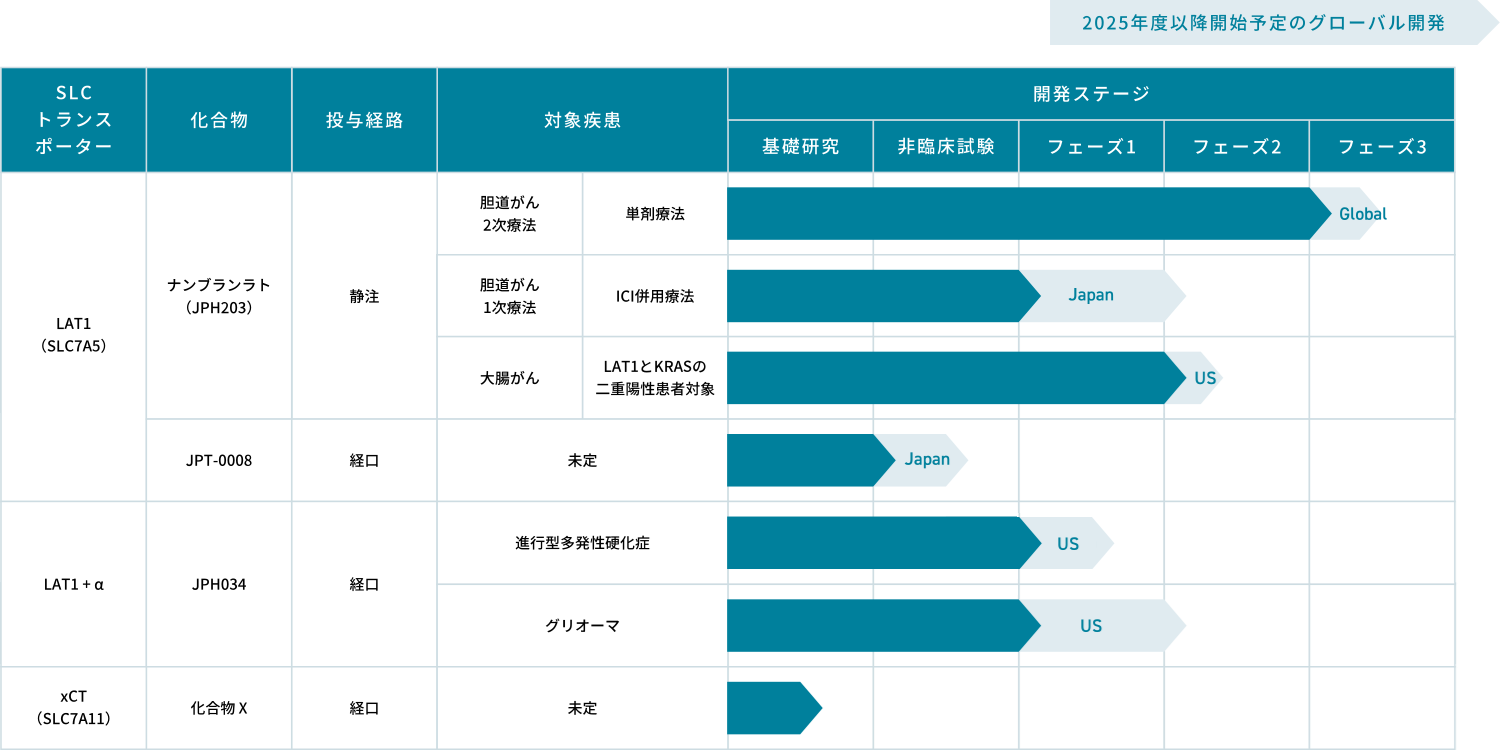
当社は、SLCトランスポーターの中で当社創業者が発見したLAT1(L型アミノ酸トランスポーター)にまずは注力し、複数の化合物(LAT1阻害剤)、適応症での開発を行なっています。
ICI: 免疫チェックポイント阻害剤(Immune Checkpoint Inhibitor)
ナンブランラト
競合的LAT1阻害剤であるナンブランラト(開発コード:JPH203)は、創業者である遠藤仁(杏林大学名誉教授)が中心となり、LAT1を標的として見出した新規の低分子化合物で、当社が研究開発を進めて参りました。 ナンブランラトは、複数の薬剤トランスポーターを介して胆管や腎臓などの臓器に高く分布、LAT1の活性を阻害し、がんの増殖を防ぐ可能性があります。特定の固形がんに対して有効性が期待され、既存治療薬が対応できない患者様のニーズに応える新規治療薬となり得ます。
最も開発が進んでいる胆道がん単剤療法においては、国内第2相臨床試験が2022年に終了しました。その試験結果は、投稿された要旨の中でも上位数%に限られている米国臨床腫瘍学会における口頭発表の機会を、2023年に2回に渡り獲得し、世界中の専門医等から高く評価されております。
この試験結果を元に各主要国において次の開発フェーズに向けて準備を進めています。米国ではオーファンドラッグ(希少疾病用医薬品)の指定を受け、グローバル第3相臨床試験に向け米国FDAと直接対話をしています。
国内第2相臨床試験(胆道がん単剤療法(2次療法以降))
【試験概要】
前治療歴のある進行性・難治性胆道がん患者に対するナンブランラトの無作為化、二重盲検、プラセボ対照の第Ⅱ相試験。国内14施設が参加し、211名の患者から同意を得て、薬剤代謝酵素(NAT2)の多型をもとに患者を層別し、104名の患者(ナンブランラト:69名、プラセボ:35名)が登録されました。本試験は胆道がんの4つの異なるサブタイプ(肝内胆管がん、肝外胆管がん、胆嚢がん、十二指腸乳頭部がん)の症例が登録され、83%の患者が標準的な化学療法および他の治験薬2剤以上に不耐性となった進行性の胆道癌でした。主要評価項目は、固形がんの治療効果判定のための新ガイドライン(RECIST 1.1)に基づき盲検下独立中央判定(BICR)によって評価された無増悪生存期間(Progression-Free Survival。以下、PFS)でした。主な副次評価項目としては、全生存期間(OS)、病勢コントロール率(DCR:CR+PR+SD)でした。
【結果の概要】
- ナンブランラトが前治療歴のある進行性・難治性胆道がん患者様を対象に、無増悪生存期間(PFS)でプラセボ群に対して統計学的に有意差を示し(ハザード比 0.56、95%信頼区間 0.34-0.90、p = 0.016 ※)、主要評価項目を達成しました
- 予後が悪いことが報告されているLAT1高発現の群におけるサブグループ解析において、ナンブランラト投与群はプラセボ群と比較して、統計的に更なる有意差を示しました(ハザード比 0.44、95%信頼区間 0.23-0.85、p = 0.01※)
- 欧米において2次療法の既存治療薬が存在しない肝外胆管がん・胆嚢がんの群でのサブグループ解析において、ナンブランラト投与群はプラセボ群と比較して、統計的に更なる有意差を示しました(ハザード比 0.22、95%信頼区間 0.10-0.49、p < 0.001※)
- 薬物有害反応(副作用)はナンブランラトが41.4%、プラセボが57.1%、グレード3以上の有害事象はナンブランラトが30.0%、プラセボが22.9%でありましたが、投与の中止/減量や死亡につながる事象はなく、ナンブランラトが良好な安全性プロファイルを示しました
- ハザード比とは統計学上の用語で、相対的な危険度を客観的に比較する方法です。臨床試験で比較検討した薬剤Aと薬剤Bにおいて、ハザード比が1であれば2つの治療法に差はなく、ハザード比が1より小さい場合には薬剤Aの方が有効と判定され、その数値が小さいほど有効であるとされます。信頼区間とp値は算出された統計データの信頼性を示す数値です。
試験結果学会発表
米国臨床腫瘍学会消化器がんシンポジウム(Gastrointestinal Cancers Symposium : ASCO GI 2023)
口頭発表 胆道がん2次療法(3次以降含む)適応とした国内第2相臨床試験主要評価項目結果
<リンク:https: //ascopubs.org/doi/abs/10.1200/JCO.2023.41.4_suppl.494?af=R >
米国臨床腫瘍学会年次総会(2023 ASCO Annual meeting) Clinical Science Symposium
口頭発表 胆道がん2次療法(3次以降含む)適応とした国内第2相臨床試験サブグループ解析結果
<リンク:https://ascopubs.org/doi/10.1200/JCO.2023.41.16_suppl.4011 >
胆道がんとナンブランラトの可能性
胆道がんは全世界で毎年20万人以上が診断されていますが、早期では無症状のことが多く、新規患者様のほとんどが進行期になってから診断されています。進行期の胆道がんでは治療選択肢が限られているため予後が不良で、5年生存率が5-15%と生存率が極めて低いがんとなっています。
胆道がんは、肝内胆管がん・肝外胆管がん・胆嚢がん・十二指腸乳頭部がんの4つのサブタイプに分類され、1次療法には化学療法および抗PD-1/PD-L1抗体薬が全サブタイプに用いられています。2次療法では分子標的薬が世界的に承認されていますが、それらの分子標的薬が対象とする遺伝子変異が起こるのは4つの胆道がんサブタイプのうちの肝内胆管がんにほぼ限られ、肝内胆管がんにおいても分子標的薬が使用可能なのは15%以下の患者様に限定されています。そのため2次療法において治療選択肢となる承認薬が極めて限られているのが現状です。また、米国の保険クレームデータを用いたリアルワールドデータの解析によると、1次療法においても過半数の患者様が化学療法剤による積極的治療を行わず、緩和ケアを受けられていることが分かっています。このように、胆道がんの治療において幅広い患者様にご使用いただける忍容性の高い安全な新薬の登場が求められています。
がん細胞に特異的に発現するLAT1のみを選択的に阻害するため安全性が高く、忍容性が確認されているナンブランラトは、このような胆道がんの治療の状況に対して新しい治療選択肢を提供し、患者様のニーズに応えることが出来る薬剤になる可能性があります。
さらにナンブランラトは、がん免疫を改善し、長期的に免疫細胞ががん細胞に対して作用する働きを向上させる効果も確認されており、既存の免疫チェックポイント阻害薬(抗PD-L1抗体薬など)との併用効果が非臨床試験のデータから確認されています。抗PD-L1抗体薬などとの併用療法の開発を進めることで、より多くの胆道がん患者様や他の固形がん患者様の治療に貢献できる可能性があります。
大腸・腎臓がんとナンブランラトの可能性
ナンブランラトは非臨床及び臨床データに基づき大腸がんや腎臓がんにも適応症拡大の可能性があり、開発を進めています。大腸がんについては、特定の遺伝子変異大腸癌において、LAT1の高発現が患者様の予後不良に強く関連する臨床データや、ナンブラントが同じ遺伝子変異大腸癌細胞株において有意な増殖抑制効果を示す非臨床試験結果が発表されています。さらに5種類の固形がんを対象に実施した第1相臨床試験では、大腸がんにおいて一定の成果を得ており、今後の開発が期待されます。腎臓がんについても大腸癌と同様に、LAT1の高発現と予後不良の明確な関連性、およびナンブランラトが腎臓がん細胞株の増殖を用量依存的に抑制する非臨床試験結果が出ています。ナンブランラトは、腎臓がんが好発する腎臓組織に多く分布するという薬剤的特性もあり、腎臓がんへの適用が期待されます。
JPH034
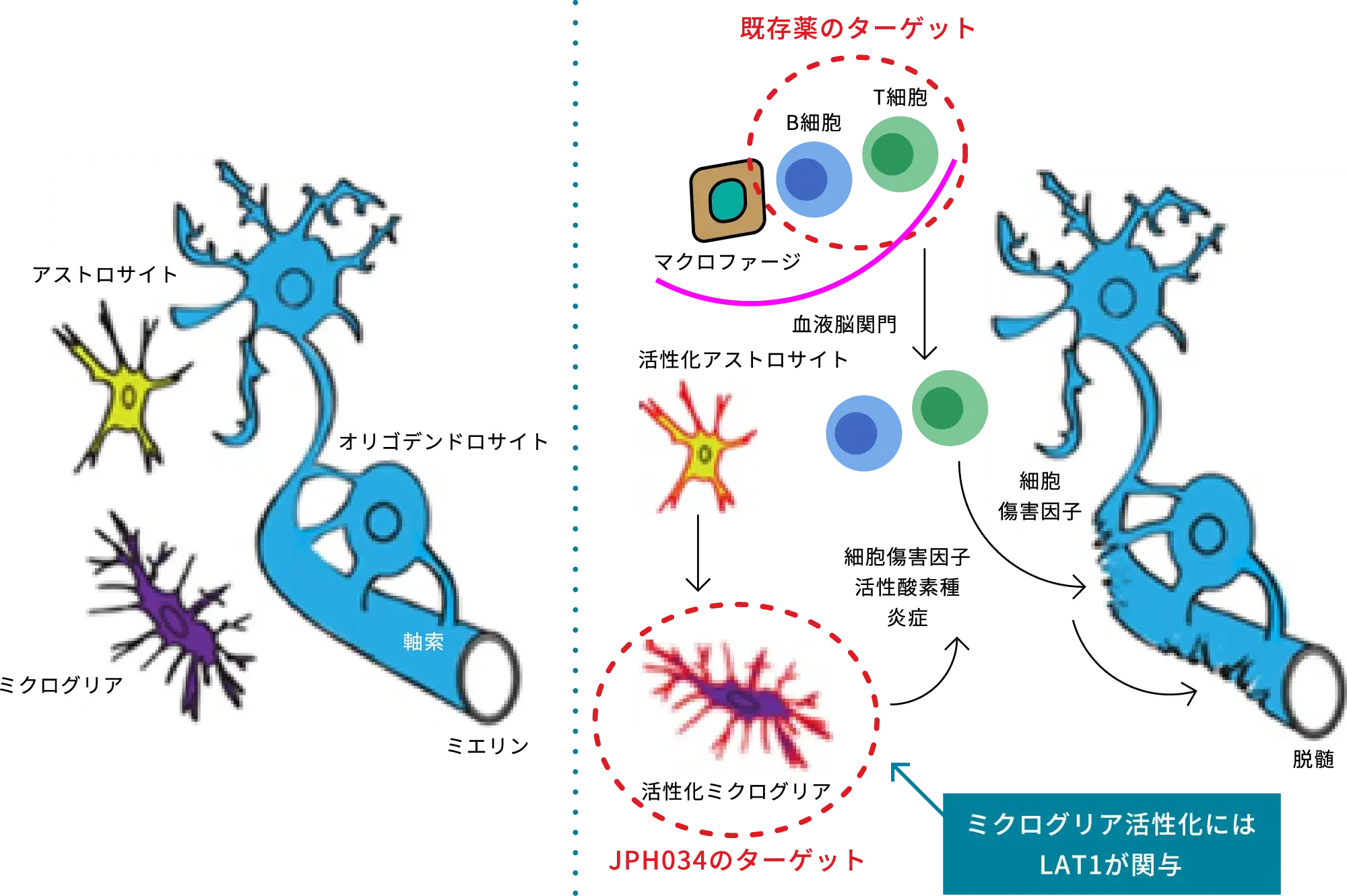
アロステリックLAT1阻害剤であるJPH034は、大阪大学大学院医学研究科の金井好克教授らによって発見され、当社では大阪大学及び神戸天然物化学株式会社より独占的通常実施権を受け、中枢神経系の自己免疫疾患の一つである進行型多発性硬化症を対象疾患として開発を進めています。JPH034は、優れた脳内移行性を示す薬剤的特徴を活かし、脳内の免疫細胞であるミクログリアの活性を抑制することで、既存治療薬では対応できない慢性的な炎症を抑え、進行型多発性硬化症の症状改善・進行抑制に繋がる可能性を持っています。
JPH034開発プログラムは、競争が激しく評価が厳しいことで知られる米国 National Multiple Sclerosis Society (NMSS) の Fast Forward Research Grant に選出され、この分野でさまざまな研究成果を世界で発表している欧米の複数の大学との共同研究により開発を進めています。共同研究先の米国の大学で実施した多発性硬化症モデルマウスを用いた実験では、JPH034により中枢神経系の脱髄病変領域における局所炎症が抑制され、再髄鞘化と共に臨床スコアの改善が確認されたため、JPH034が多発性硬化症に有効であることが示唆されました。この点をさらに探索するため、欧州の大学において薬剤の介入を伴わない臨床研究を進めており、中枢神経系の炎症要因の一つであるミクログリアの活性化とLAT1の発現が脱髄病変領域で共存するか否かを検証し、JPH034の治療効果として、進行型多発性硬化症の進行抑制(炎症抑制と再髄鞘化)と機能改善(EDSSスコアの改善)がともに期待できる患者層を見いだそうとしています。また、海外での第1相臨床試験を開始する準備も進めています。
多発性硬化症とJPH034の可能性
多発性硬化症の患者様には若年成人女性が多く、慢性の経過を示す炎症性脱髄性神経疾患で、全世界で毎年10万人以上が診断されています。進行型多発性硬化症では、感覚障害・視覚障害・運動麻痺などが生じ、四肢の不自由や車椅子での日常生活を余儀なくされることもあり、厚生労働省から難病指定されています。既存薬は多数存在しますが、再発寛解型・2次性進行型・1次性進行型の3つに分類される病型のうち、主に再発寛解型を対象としており、2次性進行型(未治療の場合、再発寛解型の約半数が移行するといわれています)や1次性進行型には有効な治療薬がない治療環境が続いています。
多発性硬化症の病状悪化の要因として、B細胞及びT細胞の活性化とミクログリアの活性化が一般的に認識されていますが、既存薬は再発寛解型多発性硬化症の末梢のB細胞及びT細胞の活性化抑制をターゲットとしています。そのため、B細胞及びT細胞の活性化を起因とする活動性炎症抑制には効果があるものの、脳内に常在するミクログリアの活性化によって進行する2次性進行型多発性硬化症における慢性的な局所炎症が治療できず、不可逆的な神経および運動機能障害に至る病状悪化を防ぐことが出来ません。JPH034は、既存薬にはみられないミクログリアの活性化をターゲットとしているため、慢性的な局所炎症を抑え、再髄鞘化を亢進することで、進行型多発性硬化症の症状改善・進行抑制に繋がる可能性を持っています。
多発性硬化症の基本メカニズムと創薬ターゲット