胆道がんは、日本および欧州5か国(イギリス、フランス、ドイツ、イタリア、スペイン)でそれぞれ年間約2万人、米国で年間約1.4万人が新たに診断される疾患です。早期には自覚症状が乏しいため、多くの患者は進行期に至ってから診断されるのが現状です。
進行期の胆道がんは治療選択肢が極めて限られており、5年生存率は25%未満と、膵臓がんに次いで生存率が低いがん種です。こうした背景から、胆道がんはアンメット・メディカル・ニーズが非常に高い疾患であり、新たな治療法の開発が強く求められております。
胆道がんにおいて、LAT1の発現量を基準に患者群を比較したところ、LAT1高発現群では生存期間が有意に短いことが確認されました。
胆道がんにおける全生存期間(OS)比較(LAT1高発現 vs. LAT1低発現)

Kaira et al., BMC Cancer. 2013, 13, 482.
この結果は、LAT1の高発現が胆道がん患者における予後を推測する指標となり得ることを示すとともに、LAT1が新たな分子標的治療の有力な候補として注目されている根拠となっております。
胆道がんは、日本では肝内胆管がん、肝外胆管がん、胆嚢がん、十二指腸乳頭部がんの4つに分類されますが、欧米では十二指腸乳頭部がんを除く3つが胆道がんとして扱われています。
1次療法では化学療法に加え、抗PD-1抗体薬や抗PD-L1抗体薬が全サブタイプにおいて用いられており、現在の標準療法は化学療法と抗PD-1/PD-L1抗体薬の併用療法です。しかしながら、この治療を受けた患者のうち24か月後に生存しているのは25%以下にとどまっており、依然として大きなアンメット・メディカル・ニーズが存在しています。特に、治療開始から25週以降は抗PD-L1抗体単剤、あるいは抗PD-1抗体+ゲムシタビンによる維持療法へ移行しますが、その間の病勢進行が課題となっています。
2次療法では分子標的薬が用いられ、米国では3種類の承認薬があります。しかし、これらの薬剤が有効な遺伝子変異(IDH1変異、FGFR2陽性、HER2陽性)を持つのは2次療法に進む患者の約30%に限られ、残り約70%の患者には有効な承認薬が存在しないのが現状です(欧州・米国での状況であり、日本では2次療法で使用可能な承認薬が存在します)。
胆道がん2次療法の治療選択肢

*各遺伝子変異陽性のみ(NCCN Guideline BTC 2025, COMPILE Claim Data Dec 2023)
ナンブランラトは、抗PD-1/PD-L1抗体との併用効果が動物モデルにおいて確認されており、1次療法において25週目以降の維持療法にアドオンすることで、標準療法と競合することなく追加的な効果を発揮できる可能性があります。
さらに2次療法においては、これまでの臨床試験の結果から、既存の承認薬が存在しない約70%の患者に対し、有効な治療選択肢の一つとなる可能性が示唆されております。安全性にも優れていることから、患者に最後まで寄り添える治療薬となる可能性を秘めております。
当社は、ナンブランラトの国内第2相臨床試験を実施しました。本試験は、胆道がん2次療法以降の患者211名をスクリーニングし、105名を無作為に割り付けた大規模な二重盲検無作為化プラセボ比較試験であり、2022年に終了しました(ナンブランラト群70名(うち1名は不適格な疾患が発見されたため解析から除外され、解析対象となったのは69名)、プラセボ群35名が解析対象)。
国内第2相臨床試験のデザイン

2023年1月に開催されたASCO GI 2023(米国臨床腫瘍学会・消化器がんシンポジウム)において、ナンブランラトが前治療歴のある進行性・難治性胆道がん患者に対し、無増悪生存期間(PFS)でプラセボ群に対して統計学的有意差を示し、主要評価項目を達成した結果が口頭発表されました(ハザード比=0.56、95%信頼区間:0.34–0.90、p=0.02)。
薬物有害反応(副作用)の発生率はナンブランラト群41.4%、プラセボ群57.1%であり、グレード3以上の有害事象はナンブランラト群30.0%、プラセボ群22.9%でした。いずれの群においても投与中止・減量や死亡に至る事象は認められず、安全性が確認されました。特にグレード3以上の有害事象率は、胆道がん2次療法で使用されることのあるFOLFOX(69%)や1次療法の標準治療であるゲムシタビン/シスプラチン+デュルバルマブ(76%)と比べても低く、ナンブランラトの良好な安全性プロファイルが示されました。この特性により、長期的治療が可能であり、現在は緩和ケアを選択している患者層への市場拡大の可能性も期待されます。
さらに、2023年6月のASCO Annual Meeting(米国臨床腫瘍学会年次総会)のClinical Science Symposiumでは、同試験のサブグループ解析が口頭発表されました。発表では、LAT1高発現群(ハザード比=0.44、95%信頼区間:0.23-0.85、p=0.01)、および肝外胆管がん・胆嚢がん群(ハザード比=0.22、95%信頼区間: 0.10-0.49、p<0.001)において、統計的にさらに有意差を示したことが説明されました。
ASCOにおける口頭発表は採択率が数%に限られることから、2023年に2回に渡りナンブランラトの臨床試験結果の口頭発表の機会が得られた事は、当社のデータが国際的に高く評価されていることを示しています。加えて、この試験結果は米国癌学会発行の学術誌「Clinical Cancer Research」(2023年9月15日号)に掲載されました。
直近では、ESMO Congress 2025において、全生存期間(OS)のサブグループ解析結果がポスター発表されました。本発表のサブグループ解析では、胆道がんのサブタイプのうち十二指腸乳頭部がん(欧米においては胆道がんに含まれない)を除く3つのサブタイプを対象とした解析においてハザード比=0.76(95%信頼区間:0.40–1.26)を示しました。加えて、2次療法患者群のみ(3次療法以降の患者群を除外)に限定した解析ではハザード比=0.55(95%信頼区間:0.09–3.54)、手術未実施患者群ではハザード比=0.53(95%信頼区間:0.228–1.01)と、良好なOS改善効果が確認されました。
ナンブランラト第2相臨床試験 OSハザード比のサブグループ解析

注1.IHC: 肝内胆管がん、EHC: 肝外胆管がん、GBC: 胆嚢がん
注2.95%信頼区間は真の値がその区間内に含まれる確率が95%であると推定される範囲
さらに、同ポスター発表では、同試験のデータを用いた暴露-反応解析も紹介されました。これは、薬剤の体内曝露量と有効性の関係を評価する解析であり、その結果、累積暴露量(Accumulated AUC)とOSの間に正の相関が認められました。また、累積暴露量(Accumulated AUC)が大きい程、腫瘍縮小の傾向が見られました。
ナンブランラトの暴露-反応解析
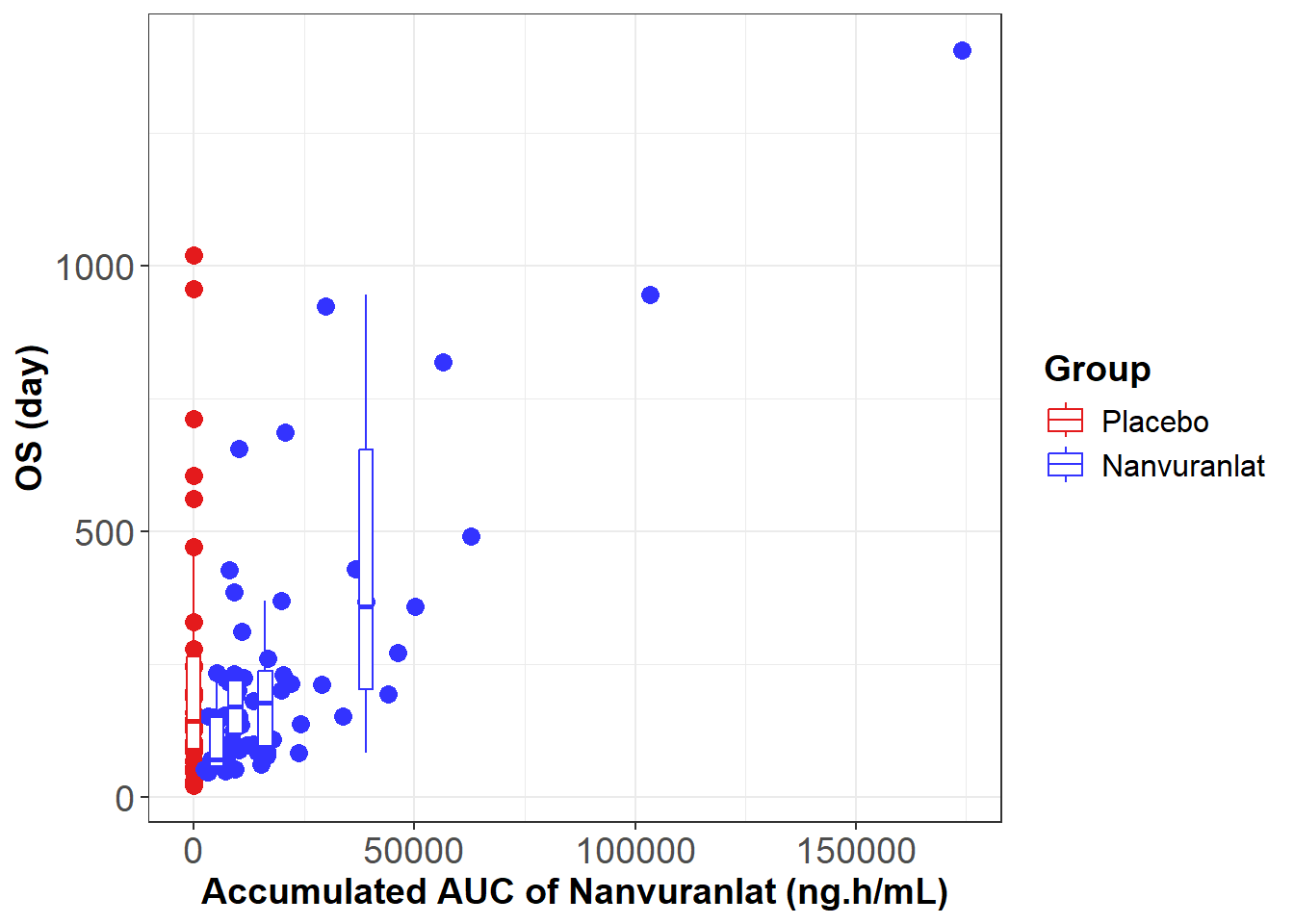
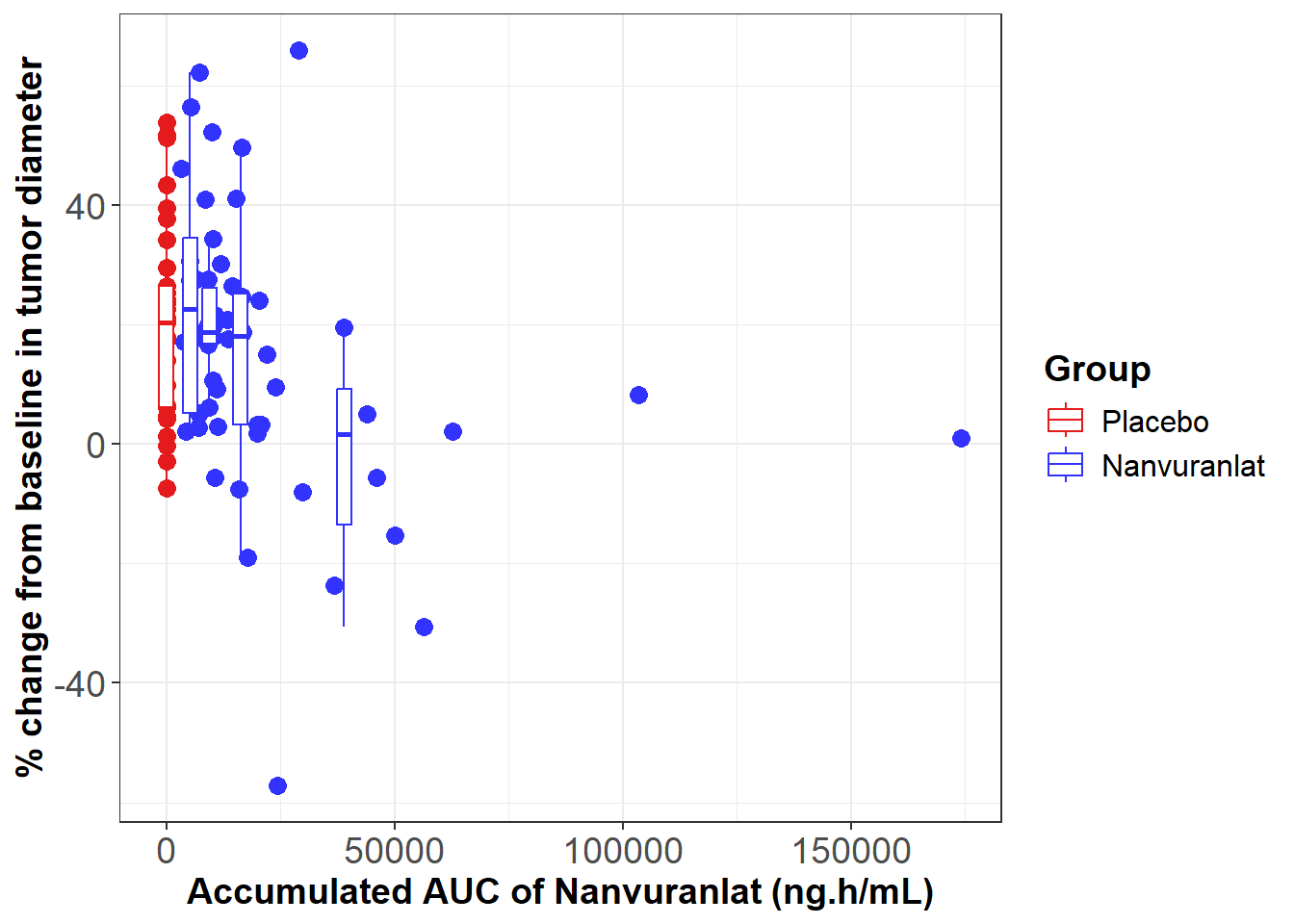
M. Ueno, et al., ESMO 2025. 98P - Subgroup analysis of a Ph.2 study of nanvuranlat in pre-treated, advanced, refractory biliary tract cancer patients (BTC) support an enriched patient population for a planned Ph.3 study.

